时间:2019-06-03

最近许多小伙伴发现,许多药品的外包装,多了一个小标识-仿制药一致性评价标识。what?仿制药?是不是假药?是不是低效药品?心中好多疑问。

原研药,即指原创性的新药,经过对成千上万种化合物层层筛选和严格的临床试验才得以获准上市。需要花费15年左右的研发时间和数亿美元,目前只有大型跨国制药企业才有能力研制,期间投入的成本是需要一定时间才能收回,这也是为什么原研药会被成为“天价药”的原因。

仿制药不是假药。新药研制后,有20年的专利保护期。到期后,法律允许对其进行仿制。当药品专利到期后,仿制药企业涌入,带来了激烈的竞争,从而使这些药品的价格大幅下降,为全社会节省了巨量的医药费用。
美国市场仿制药的处方量在全部处方中的占比为85.5%,但仅占销售额的11.8%,可以说,仿制药以略多于一成的支出,解决了超过八成的临床用药需求。(数据来源:IQVIA发布的2018年度《仿制药及生物类似物的趋势、问题及展望》报告)
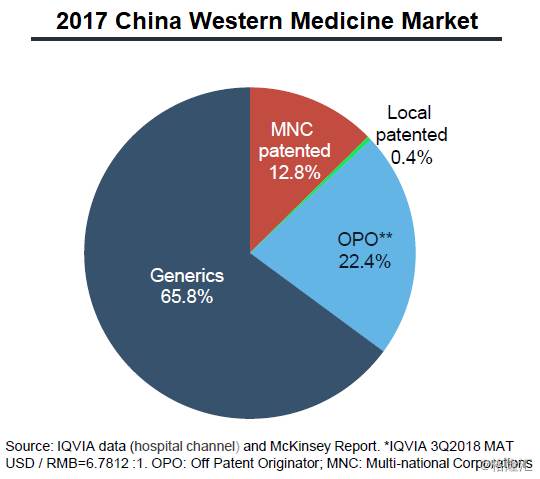
中国仿制药处方量占比,约为65.8%。
是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。
近几年才开始实行一致性评价,后期将会普及,只有通过一致性评价才足以证明在质量疗效达到原研药一致的水平,同时优先纳入国家医疗集采和医保统筹。
国家卫健委发布的《国家基本药物目录(2018年版)》中,有685个基药,其中106个类别已经通过一致性评价。(截至2018年12月31日)

通过评价的,就会加上一致性评价标识

一致性评价简单点说就是:仿制药的质量与药效上达到与原研药一致的水平,在药盒外包装上加个一致性评价LOGO。
2012年,国家食药监总局(CFDA)启动15个试点品种的质量一致性评价工作
2013年2月,CFDA发布《仿制药质量一致性评价工作方案》
2015年8月18日,由国务院印发的《关于改革药品医疗器械审评审批制度的意见》
2016年3月5日,CFDA转发了国务院办公厅发布的《关于开展仿制药质量和疗效一致性评价的意见》,意味着一致性评价的大幕事实上已正式拉开。
截止到2018年12月31日,已通过一致性评价名单中,有141个规格,共106个类别,涉及66个生产厂家。
其中,我们日常熟知的百适可 草酸艾司西酞普兰片 、奥夫平 奥氮平片、枢贝 奥氮平口崩片、欧兰宁 奥氮平片 10mg*7片/盒、博思清 阿立哌唑口腔崩解片等,都是已通过一致性评价的产品。
国家法律层面允许制药工业仿制国外专利到期的药品,除了功效质量达到一致外,同时推动了价格的下降,许多国内药品的价格,是原研药的一半左右,有的甚至更低。
通过一致性评价的仿制药,其质量跟原研药一致。临床上优先使用这些“可替代”的仿制药,能够大大降低百姓的用药负担,减少医保支出,提高医保基金的使用效率。
邻国印度更是开了挂,白血病治疗用药原研药格列卫需要25000元/盒,印度仿制药甚至做到了980元/盒,价格是原研药的4%。

有些小伙伴有些疑惑,我吃了这么多年,竟然是仿制药,仿别人的,是不是效果是会比国外的原研药差一些的呢?
按照法规规定,仿制药与原研药必须具有完全相同的活性成分,相同的含量、相同的药效。而一致性评价,就是国家通过多年的复核检验与核查,在药效和质量上,已达到原研药一致的水平。
目前我们服用的药品如果增加了一致性评价的标识,说明质量疗效已达到原研药一致性的水平,是质量疗效更优质,更有保障的体现。
药厂通过一致性评价后,会更换新包装,新包装都要在显著位置加入一致性评价标识。
市场上流通的药品,药店库存较少,大概在两三个月,就会售完旧包装药品,就会销售新包装药品。
而医院作为药品的主要使用场所,库存大,药品会在6-9个月内使用完旧包装药品,届时会陆续更换为新包装药品。
市场上有些有标识,有些没有,这些都是符合药监局对药品的管理规定的。










